تعتبر الكيمياء في البداية واحدة من أهم العلوم الطبيعية ، بما في ذلك علوم الأرض والبيولوجيا والفيزياء وعلم الفلك ، وهذا العلم هو الذي يدرس التغيرات التي تحدث. المادة في حالاتها الأربع: “الغازية والسائلة”. الحالة الصلبة والبلازما ، فضلا عن دراسة التكوين والخصائص والخصائص والهيكل والعوامل التي تؤثر على المواد والبيئة. العالم العربي المسلم جابر بن حيان هو المؤسس الحقيقي للكيمياء ، الذي وصفه العرب في الماضي بأب الكيمياء.
اشرح كيف يختلف النموذج النووي للذرة عن النموذج النووي للكرة الصلبة
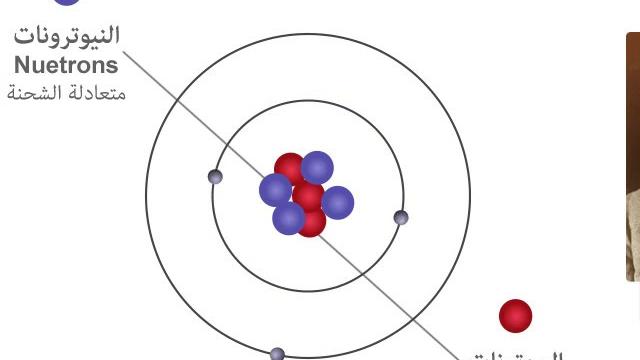
قبل الحديث عن الإجابة على السؤال ، وشرح كيف يختلف النموذج النووي للذرة عن نموذج الكرة الصلبة ، كان علينا أن نقدم الطلاب إلى المفهوم العام للنموذج النووي للذرة ، وهو أحد النماذج المفاهيمية الهامة المستخدمة في بنية الذرة. صاغ العالم إرنست رذرفورد هذا النموذج لأول مرة بمساعدة هانز جايجر وإرنست مارسدن في عام 1909 ، لأن هذا النموذج يسمح للعلماء بالتأكد من أن الذرة ليست في نهاية المطاف جسما واحدا ، وأن الذرات لها نواة ، مشحونة إيجابيا ، كما اكتشف العلماء لاحقا باستخدام الأشعة السينية أن العدد المتوقع من الإلكترونات هو نفس العدد الذري للإلكترونات.:
- لا تؤثر سحابة ذرات الإلكترون على تشتت جسيمات ألفا.
- تتركز معظم الشحنة الموجبة في حجم صغير نسبيا في وسط الذرة.
- تتركز الذرات الثقيلة في المنطقة الوسطى من الشحنة ، مثل الذهب.
- قطر الذرة نفسها يمكن أن تكون حوالي 100 ، 000 مرة من قطر النواة.
نظرية الكرة الصلبة دالتون
استخدم الكيميائي جون دالتون العديد من القرائن الكيميائية والفيزيائية المعروفة في ذلك الوقت ، استنادا إلى حقائق ملموسة وملاحظات وصفية ، لبناء مفهومه للذرة. بين عامي 1803 و 1808 ، والذي استند إلى ثلاثة افتراضات:
- يتكون العنصر الكيميائي من جسيمات متناهية الصغر.
- جميع ذرات العنصر متساوية في الكتلة والخصائص.
- تتحد ذرات العناصر بنسب عددية ثابتة لتشكيل مركبات كيميائية.
بالنسبة للإجابة على السؤال ، اشرح كيف يختلف النموذج النووي للذرة عن نموذج الكرة الصلبة الموضح في الصورة أدناه:
في نهاية الموضوع ، يمكن تعريف الذرة كيميائيا بأنها أصغر حجر بناء وأصغر جزء من عنصر كيميائي يمكن الوصول إليه ويحتفظ بجميع الخصائص الكيميائية للعنصر.
